1. Patogen
Ludzka anaplazmoza granulocytowa (HGA) jest zakażeniem przenoszonym przez kleszcze, wywoływanym przez bakterię Anaplasma phagocytophilum , małą bakterię infekującą typowo neutrofile przenoszone przez kleszcze Ixodes . Anaplazmoza granulocytowa jest najbardziej rozpowszechnioną infekcją przenoszoną przez kleszcze u zwierząt w Europie . Osobniki są najbardziej zagrożone, gdy kleszcze są aktywne w okresie od wiosny do jesieni.
Pomimo rosnącej częstości występowania Anaplasma phagocytophilum u gospodarzy zwierzęcych, przypadki u ludzi nie są częste, choć prawdopodobnie są one niedoszacowane ze względu na niespecyficzne objawy kliniczne (objawy grypopodobne). Szczepy amerykańskie wykazywały wyższą zachorowalność i śmiertelność (<1%) i do tej pory nie zgłoszono żadnego przypadku śmiertelnego u ludzi w Europie.
2. Cechy kliniczne i następstwa
Czasy inkubacji są różne, wahają się od 5 do 21 dni, przy czym większość przypadków ma miejsce między kwietniem a październikiem. Obraz kliniczny to zwykle ostre niespecyficzne zakażenie gorączkowe (czas trwania 2-11 dni). Spośród zakażonych 70-95% ma gorączkę (>38,5°C), złe samopoczucie, bóle mięśni i bóle głowy, niektórzy mają również bóle stawów, zajęcie wątroby (podwyższone transaminazy wątrobowe), ośrodkowy układ nerwowy (splątanie, problemy neurologiczne), żołądkowo-jelitowe (nudności i wymioty) lub objawy ze strony układu oddechowego (trudności w oddychaniu). Wysypka (rumieniowa, bez świądu) może wystąpić u mniejszości pacjentów. Infekcje śmiertelne występują rzadko, ale infekcja może kumulować się w awarii wielosystemowej. Podejrzenie należy wzbudzić u pacjentów z narażeniem na kleszcze z małopłytkowością i/lub leukopenią. Przypadki były związane z transfuzją krwi zA. phagocytophilum przeżywający tydzień w schłodzonych próbkach krwi.
Infekcja przejściowa może wystąpić przy braku powiązanych objawów klinicznych, w związku z czym przypadki nie zawsze mogą być wykryte. Należy zbadać współzakażenie innymi patogenami przenoszonymi przez kleszcze, szczególnie w przypadkach, gdy wystąpiła wysypka.
Chociaż przypadki nabyte w Europie mają podobny obraz kliniczny obserwowany w USA, przypadki europejskie są ogólnie uważane za łagodniejsze. Istnieją dowody na heterogeniczność szczepów, która może korelować z predylecjami gospodarza i wynikającą z tego patogenezą. Większość europejskich przypadków HGA ma postać łagodnej lub nawet bezobjawowej infekcji, z całkowitym wyzdrowieniem w ciągu 2 tygodni, nawet przy braku specyficznego leczenia (Bakken i Dumler, 2006).
3. Transmisja
Głównym rezerwuarem A. phagocytophilum w Europie jest kleszcz I. ricinus , którego częstość występowania w krajach waha się od 0,5% do 34% , z dużą zmiennością w obrębie krajów i między nimi. W Europie Środkowo-Wschodniej wysoką zmienność chorobowości stwierdzono w różnych krajach, od niskich wartości na Węgrzech i w Republice Mołdawii (0,5%-2,4%), średnich wartości na Słowacji i w Rosji (8%-9%) do wysokich wartości 34 % w Bułgarii. Jednak na tę zmienność mogą mieć wpływ same badania (stosowana metoda, geny docelowe), struktura populacji kleszczy, ponieważ częstsze występowanie bakterii stwierdzono u dorosłych w porównaniu z nimfami (Matei et al. 2015) lub wzorce geograficzne i struktura siedliska. Inne Ixodykleszcze zostały również zamieszane jako nosiciele. W Europie Wschodniej gatunek I. persulcatus został również odnotowany jako istotny wektor (Stuen et al. 2015). Inne gatunki należące do rodzaju Ixodes wydają się być zaangażowane w odrębne podcykle epidemiologiczne (Silaghi et al. 2012).
Choroba rozprzestrzenia się najczęściej poprzez ukąszenie kleszcza. Kleszcz może zarazić się po żerowaniu na zarażonych żywicielach. Szczepy chorobotwórcze dla ludzi mogą być przenoszone na kleszcze przez żywienie konia, psa, przeżuwaczy domowych lub dzikich (niektóre szczepy), jeży i dzików. Zaobserwowano inne sposoby przenoszenia A. phagocytophilum . W USA i Europie opisano przypadki ludzkiej anaplazmozy granulocytarnej po przetoczeniu krwi lub krwinek czerwonych. W USA opisano również transmisję okołoporodową z matki na dziecko.
Grupy ryzyka
Wszystkie osoby narażone na ryzyko pogryzienia przez kleszcze, a w szczególności:
- Ludzie żyjący na terenach endemicznych dla kleszczy
- Osoby mieszkające na obszarach wiejskich
- Pracownicy farmy
- Pracownicy leśny
- Myśliwi (będący w bliskim kontakcie z żywicielami rezerwuarowymi i ich kleszczami)
- Osoby, które mają psy (spędzają więcej czasu w parkach ze swoimi psami)
- Osoby podróżujące do endemicznych obszarów HGA
4. Zapobieganie
Obecnie nie jest dostępna żadna licencjonowana szczepionka, więc aby zapobiec zakażeniu, należy podjąć środki ostrożności w celu uniknięcia narażenia na kleszcze (unikać obszarów z wysoką trawą, paprociami itp.) poprzez noszenie odpowiedniej odzieży (tj. , szczególnie kończyny, wsuwaj spodnie do skarpet). Stosowanie środków odstraszających owady (zwłaszcza z DEET lub permetryną) zarówno do skóry, jak i odzieży, częste kontrole skóry pod kątem przyczepionych kleszczy, szczególnie pod koniec dnia (zwłaszcza pachy, pachwiny, nogi, pępek, szyja i głowa; głowa na linii włosów dzieci) należy zachęcać, ponieważ wczesne usunięcie minimalizuje ryzyko przeniesienia zakażenia. Usunięcie polega na uchwyceniu kleszcza jak najbliżej aparatu gębowego za pomocą pęsety lub pęsety, a następnie delikatne wyciągnięcie go prosto, bez ściskania, szarpania i skręcania. Miejsce należy umyć mydłem i wodą, a następnie zastosować środek dezynfekujący skórę (alkohol, jod), jeśli jest dostępny. Nigdy nie należy stosować metod usuwania, które obciążają kleszcza (benzyna, olej lub zapałka), ponieważ pod wpływem stresu kleszcz może uwolnić dużą ilość materiału zawierającego bakterie w miejscu ugryzienia. Usunięty kleszcz należy zawinąć w papier toaletowy za pomocą pęsety i spłukać w toalecie. Więcej szczegółowych informacji można znaleźć na stronie ECDC:https://ecdc.europa.eu/en/disease-vectors/prevention-and-control/protective-measures-ticks
5. Diagnoza
Rozpoznanie anaplazmozy jest zwykle podejrzewane na podstawie objawów klinicznych i wywiadu chorobowego pacjenta, a następnie może być potwierdzone za pomocą specjalistycznych potwierdzających badań laboratoryjnych. Objawy HGA mogą różnić się w zależności od pacjenta i mogą być trudne do odróżnienia od innych chorób. W postawieniu diagnozy pomocne mogą być informacje dotyczące niedawnych ukąszeń kleszczy, narażenia na obszary, w których mogą występować kleszcze, lub historia niedawnych podróży do obszarów, w których HGA występuje endemicznie.
Pracownik służby zdrowia powinien również wziąć pod uwagę wyniki rutynowych badań krwi, takich jak pełna morfologia krwi lub panel chemiczny. Trombocytopenia, leukopenia lub podwyższony poziom enzymów wątrobowych są pomocnymi predyktorami anaplazmozy, ale nie występują u wszystkich pacjentów. Po postawieniu podejrzenia diagnozy na podstawie podejrzenia klinicznego i rozpoczęciu leczenia należy wykonać specjalistyczne badania laboratoryjne w celu potwierdzenia rozpoznania anaplazmozy.
Złotym standardem serologicznym testem do diagnozowania anaplazmozy jest pośredni test immunofluorescencyjny (IFA) z użyciem antygenu A. phagocytophilum , wykonywany na sparowanych próbkach surowicy w celu wykazania znaczącego (czterokrotnego) wzrostu miana przeciwciał. Pierwsza próbka powinna zostać pobrana w pierwszym tygodniu choroby (i generalnie jest negatywna), a druga 2 do 4 tygodni później. Przeciwciała IgM są mniej specyficzne niż przeciwciała IgG i mają większe prawdopodobieństwo uzyskania wyników fałszywie dodatnich. Same wyniki IgM nie powinny być wykorzystywane do diagnostyki laboratoryjnej.
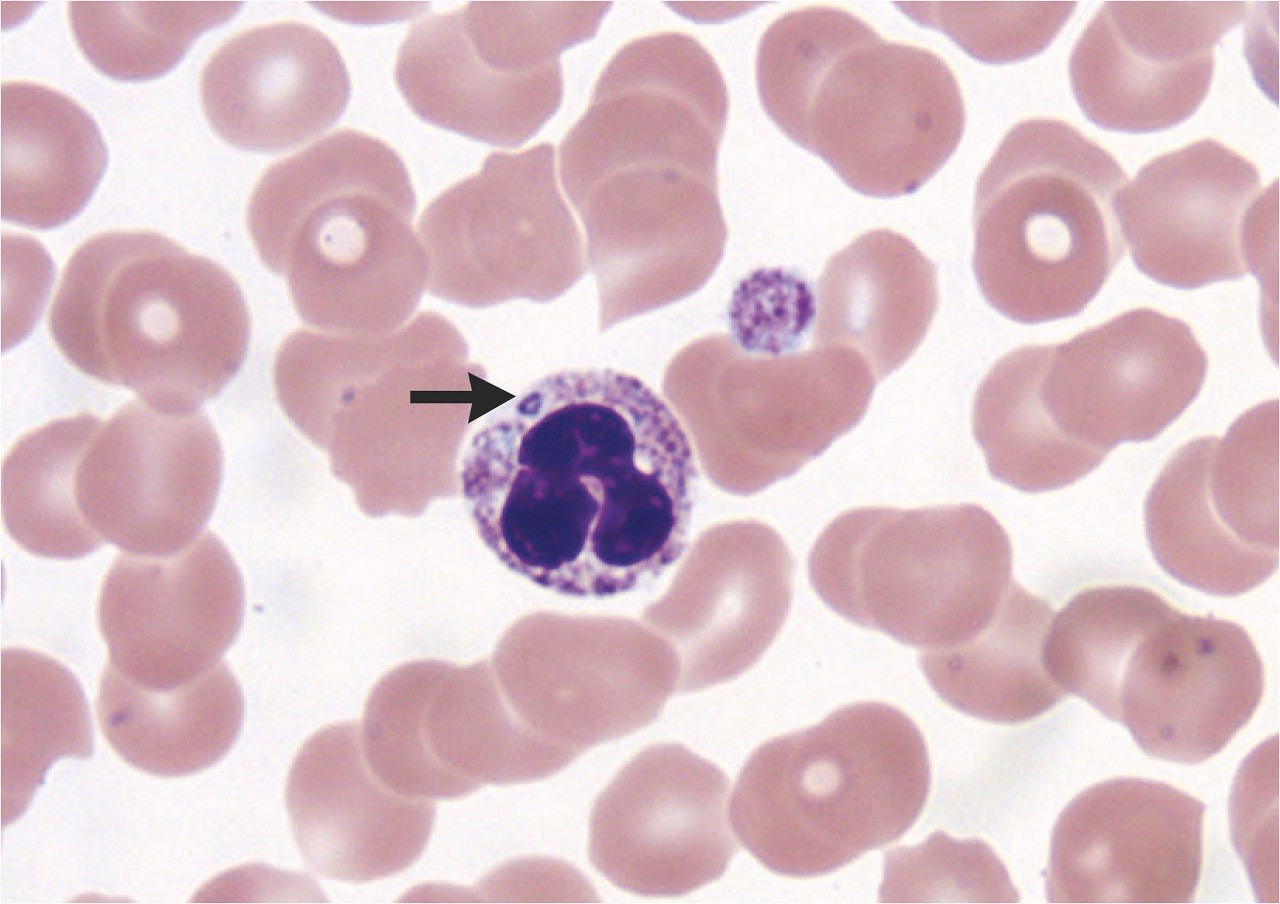
W ostrej fazie choroby krew pełną można zbadać za pomocą reakcji łańcuchowej polimerazy (PCR). Ta metoda jest bardzo czuła na wczesnym etapie, ale szybko traci czułość po odpowiednim podaniu antybiotyków. Ponadto wynik ujemny nie wyklucza rozpoznania, ponieważ sporadyczne poziomy bakteriemii mogą dawać wyniki fałszywie ujemne. W pierwszym tygodniu choroby mikroskopowe badanie rozmazów krwi może ujawnić morule anaplazmyw cytoplazmie białych krwinek, ale tylko u 20% pacjentów. Testy immunoenzymatyczne (EIA) są dostępne w niektórych komercyjnych laboratoriach. Jednak testy EIA są raczej jakościowe niż ilościowe, co oznacza, że dają tylko wynik dodatni/ujemny i są mniej przydatne do pomiaru zmian w mianach przeciwciał pomiędzy parami próbek. Identyfikacja poprzez izolację posiewu nie jest rutynowo dostępna, a rutynowe szpitalne posiewy krwi nie pozwalają na wykrycie A. phagocytophilum .
6. Zarządzanie i leczenie
Nie zaleca się profilaktyki po ukąszeniu kleszcza, nawet w regionach endemicznych. Lekiem z wyboru w leczeniu HGA u dorosłych i dzieci (w tym w wieku poniżej 8 lat) jest doksycyklina i należy ją stosować wyłącznie w przypadku podejrzenia klinicznego. Terapia jest najskuteczniejsza, gdy rozpoczyna się na wczesnym etapie choroby. Doksycyklina jest wysoce skuteczna i nie odnotowano nawrotów po leczeniu. Na ogół następuje szybka odpowiedź na leczenie z wyraźną poprawą kliniczną w ciągu 24 do 72 godzin. Możliwą alternatywą dla pacjentek z alergią na doksycyklinę lub z łagodną chorobą w czasie ciąży jest ryfampicyna. Inne antybiotyki, takie jak chinolony, cefalosporyny, penicyliny i makrolidy, są nieskuteczne (St Clair i Decker, 2012; Bakken i Dumler, 2015; Dumler i Walker, 2015).